医疗器械CE认证
欧盟为规范其市场,统一产品标准和规范,规定在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求。这是欧盟法律对产品提出的一种强制性要求,出口到欧盟的医疗器械没有CE认证无法清关。
医疗器械欧盟分类
根据欧盟新颁布的医疗器械法规《医疗器械法规》(2017/745,MDR)和《体外诊断器械法规》(2017/746,IVDR),现在欧盟范围内医疗器械只分两类:医疗器械MD和体外诊断器械IVD。
根据申明的产品预期使用目的,如果产品是侵入式的或接触到皮肤的,则属于MDR管辖的医疗器械MD;如果是非侵入式的或完全接触不到皮肤的,则属于IVDR管辖的体外诊断器械IVD。
根据《医疗器械法规》(MDR),医疗器械MD根据风险等级分为 I、IIa、 IIb、III类。
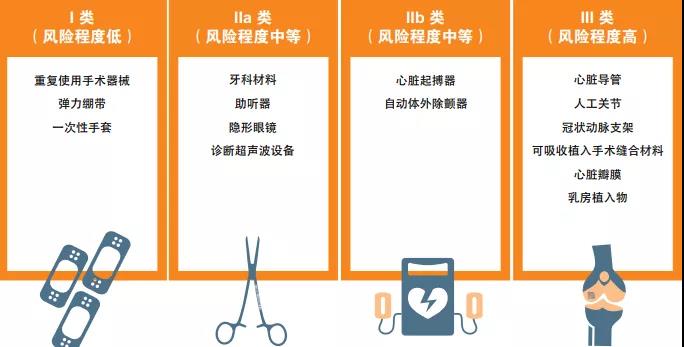
2017年欧盟颁布的两个新法规2017年生效,但有一定过渡期,分别于2021年5月和2022年5月强制实施。
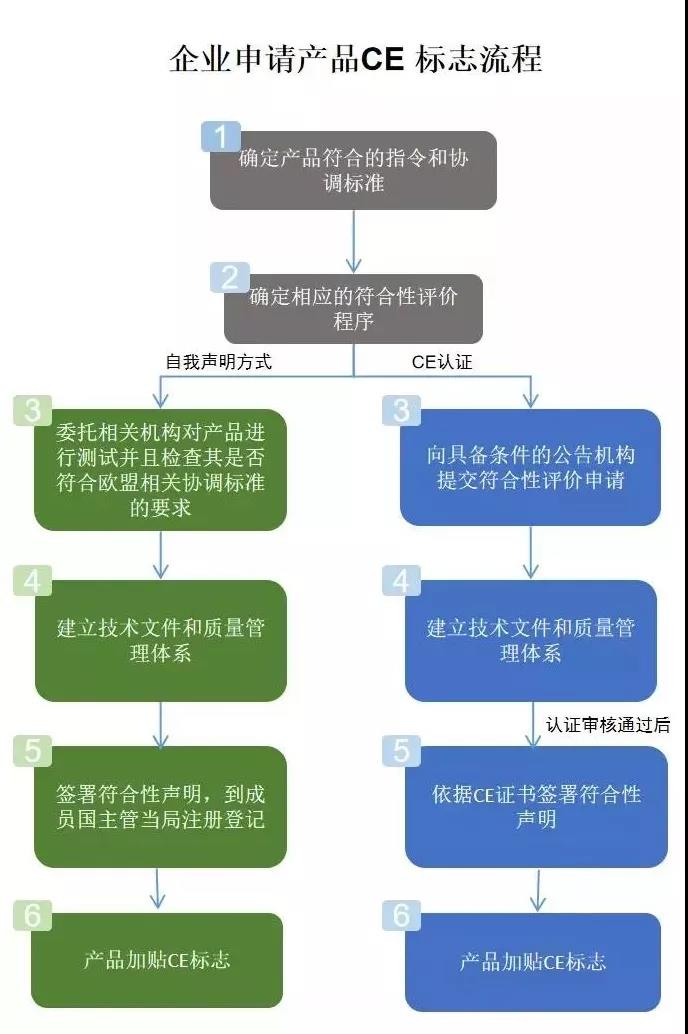
医疗器械CE认证流程:
医疗器械需要满足的指令有:
《有源植入性医疗器械指令》(AIMDD,90/385/EEC)
《医疗器械指令》(MDD,93/42/EEC)体外诊断器械指令(IVDD,98/79/EC)
医疗器械指令(MDD),MDD指令适用于大多数进入欧盟销售的医疗设备。它根据不同的要求共分为6个等级,供认证机构评估。
类别 | 设计阶段 | 生产阶段 |
I 级 | 自我符合声明 | 自我符合声明 |
I 级(测量功能) | 自我符合声明 | 申报机构 |
I 级(灭菌) | 自我符合声明 | 申报机构 |
IIa级 | 自我符合声明 | 申报机构 |
IIb级 | 申报机构 | 申报机构 |
III级 | 申报机构 | 申报机构 |
认证机构的统一评估包括根据指令规定的基本要求评审技术文件、根据标准EN 46001或EN/ISO 13485评审质量体系。
由于美国、加拿大和欧洲普遍以ISO 9001,EN 4600或ISO 13485作为质量保证体系的要求,故建议质量保证体系的建立均以这些标准为基础。
体外诊断医疗器械指令(IVDD),IVDD的要求与MDD相似,可按以下分类申请:
类别 | 设计阶段 | 生产阶段 |
基本指令 | 自我符合声明 | 自我符合声明 |
自我测试指令 | 申报机构 | 自我符合声明 |
“A”列指令 | 申报机构 | 申报机构 |
“B”列指令 | 申报机构 | 申报机构 |



 微信公众号
微信公众号